
膠原探索
Ⅱ型膠原蛋白對(duì)人軟骨細(xì)胞生物學(xué)特性的影響
蔣 萍,蔚 芃,趙明才,陳 瓊,王 梓(川北醫(yī)學(xué)院附屬醫(yī)院骨科,四川省南充市 637000)
蔣萍,女,1983 年生,四川省南充市人,漢族,2012年川北醫(yī)學(xué)院畢業(yè),碩士, 醫(yī)師,主要從事骨與關(guān)節(jié)損傷修復(fù)研究。
通訊作者:蔚芃,主任醫(yī)師,川北醫(yī)學(xué)院附屬醫(yī)院骨科,四川省南充市637000
文章亮點(diǎn):
1.膠原蛋白作為天然高分子生物材料已被證實(shí)可作為軟骨組織工程支架材料,并且它作為底物能刺激軟骨細(xì)胞生長(zhǎng),可用于體外軟骨細(xì)胞培養(yǎng),但關(guān)于不同類型膠原蛋白刺激成軟骨作用的能力仍存在爭(zhēng)議。
2.實(shí)驗(yàn)創(chuàng)新性使用Ⅰ、Ⅱ型膠原包被培養(yǎng)板和普通培養(yǎng)板同時(shí)培養(yǎng)人軟骨細(xì)胞,研究Ⅰ、Ⅱ型膠原蛋白對(duì)人軟骨細(xì)胞生物學(xué)特性的影響。發(fā)現(xiàn)膠原蛋白包被培養(yǎng)板培養(yǎng)軟骨細(xì)胞優(yōu)于普通培養(yǎng)板,其中Ⅱ型膠原蛋白包被培養(yǎng)板在培養(yǎng)軟骨細(xì)胞時(shí)更能維持細(xì)胞形態(tài),延長(zhǎng)去分化現(xiàn)象出現(xiàn)的時(shí)間,更利于細(xì)胞再分化。
關(guān)鍵詞:
生物材料;軟骨生物材料;Ⅰ型膠原蛋白培養(yǎng)板;Ⅱ型膠原蛋白培養(yǎng)板;人軟骨細(xì)胞;體外培養(yǎng)
主題詞:
膠原Ⅰ型;膠原Ⅱ型;軟骨細(xì)胞
基金資助:
四川省衛(wèi)生廳項(xiàng)目
摘要
背景:實(shí)驗(yàn)證明膠原蛋白底物具有刺激成軟骨的作用,但關(guān)于不同類型膠原蛋白刺激成軟骨作用的能力仍存在爭(zhēng)議。
目的:觀察Ⅰ、Ⅱ型膠原蛋白對(duì)體外培養(yǎng)人軟骨細(xì)胞生物學(xué)特性的影響。
方法:將 P3 代人軟骨細(xì)胞分別加入普通培養(yǎng)板、Ⅰ型膠原蛋白包被培養(yǎng)板、Ⅱ型膠原蛋白包被培養(yǎng)板繼續(xù)培養(yǎng)。培養(yǎng) 10 d 內(nèi),MTT 法繪制細(xì)胞生長(zhǎng)曲線;培養(yǎng) 28 d 后,采用 ELISA 法、聚合酶鏈反應(yīng)、二甲基亞甲基藍(lán)比色等方法檢測(cè) 3 種培養(yǎng)板中軟骨細(xì)胞分泌Ⅰ膠原蛋白、Ⅱ型膠原蛋白及糖胺多糖的量。
結(jié)果與結(jié)論:Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞數(shù)量最多,增殖速度為Ⅰ型膠原蛋白包被培養(yǎng)板的 2 倍、
普通培養(yǎng)板的 5 倍。Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞分泌Ⅰ型膠原蛋白最少,與普通培養(yǎng)板板檢測(cè)結(jié)果差異有顯著性意義(P < 0.01),與Ⅰ型膠原蛋白包被培養(yǎng)板檢測(cè)結(jié)果差異無(wú)顯著性意義;Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞分泌Ⅱ型膠原蛋白、糖胺多糖最多,與其他兩種培養(yǎng)板檢測(cè)結(jié)果差異有顯著性意義(P < 0.01)。表明膠原蛋白包被培養(yǎng)板培養(yǎng)軟骨細(xì)胞優(yōu)于普通培養(yǎng)板,其中Ⅱ型膠原蛋白包被培養(yǎng)板在培養(yǎng)軟骨細(xì)胞時(shí)更能維持細(xì)胞形態(tài),延長(zhǎng)去分化現(xiàn)象出現(xiàn)的時(shí)間,更利于細(xì)胞再分化。
蔣萍,蔚芃,趙明才,陳瓊,王梓.Ⅰ、Ⅱ型膠原蛋白對(duì)人軟骨細(xì)胞生物學(xué)特性的影響[J].中國(guó)組織工程研究,
2014,18(30):4845-4850.
Effect of type I or type II collagen on biological characteristics of human chondrocytes
Jiang Ping, Master, Physician, Department of Orthopedics, Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, Sichuan Province, China
Corresponding author: Wei Peng, Chief physician, Department of Orthopedics, Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, Sichuan Province, China
Accepted: 2014-05-21
Jiang Ping, Wei Peng, Zhao Ming-cai, Chen Qiong, Wang Zi (Department of Orthopedics, Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, Sichuan Province, China)
Abstract
BACKGROUND: Experiments have shown that the collagen substrate has the capability of stimulating cartilage generation, but the stimulating role of different types of collagen substrates remains controversial.
OBJECTIVE: To investigate the effect of type I and type II collagen on the biological characteristics of human chondrocytes cultured in vitro.
METHODS: Human chondrocytes at passage were cultured onto the ordinary culture plates (ordinary plate), type I collagen-coated culture plates (type I plate), and type II collagen-coated culture plates (type II plate). Cell growth curves were determined by MTT method after cells were cultured for 10 days. By ELISA, PCR, and 1,9-dimethyl methyleneblue technology, type I and type II collagen and glycosaminoglycan contents were quantitatively detected in cartilage cells 28 days after culture.
RESULTS AND CONCLUSION: The number of cartilage cells was the highest in type II plate, which was twice of that in type I plate and five times of that in ordinary plate. Cartilage cells in type II plate secreted the least amount of type I collagen, which showed significant differences compared with the ordinary plate (P < 0.01) and had no statistically significant difference with type I plate (P > 0.01). Cartilage cells in type II plate secreted the most amount of type II collagen and glycosaminoglycan, showing significant differences compared with the other two plates (P < 0.01). The cartilage cells cultured in collagen plates are better than that cultured in ordinary culture plate, type II collagen culture plate is better than type I collagen culture plate in maintaining cell shape, extending the dedifferentiation pattern, and promoting cell differentiation.
Subject headings: collagen type I; collagen type II; chondrocytes
Funding: a grant by Sichuan Provincial Health Ministry
Jiang P, Wei P, Zhao MC, Chen Q, Wang Z. Effect of type I or type II collagen on biological characteristics of human chondrocytes. Zhongguo Zuzhi Gongcheng Yanjiu. 2014;18(30):4845-4850.
引言
隨著組織工程學(xué)的發(fā)展,軟骨組織工程學(xué)為人們提供了更為理想的修復(fù)關(guān)節(jié)軟骨缺損方法。如何獲得大規(guī)模具有增殖活性的種子細(xì)胞為當(dāng)前面臨的最大限制因素之一。
1994年Brittberg[1]體外培養(yǎng)患者健康軟骨細(xì)胞,獲得大量純化軟骨細(xì)胞,再移植到其關(guān)節(jié)軟骨缺損部位治療關(guān)節(jié)軟骨缺損,開(kāi)創(chuàng)了應(yīng)用自體軟骨細(xì)胞移植治療軟骨損傷的新技術(shù)。該技術(shù)在1997年得到美國(guó)FDA正式批準(zhǔn)后已在歐洲國(guó)家廣泛使用,獲得大量純化且具有再生活力的軟骨細(xì)胞是該技術(shù)的關(guān)鍵,但在實(shí)驗(yàn)過(guò)程中發(fā)現(xiàn)軟骨細(xì)胞體外培養(yǎng)傳代會(huì)發(fā)生去分化現(xiàn)象,喪失成軟骨能力。
為了解決體外培養(yǎng)軟骨細(xì)胞的去分化現(xiàn)象,越來(lái)越多的研究被報(bào)道,早在1975年就有實(shí)驗(yàn)證明膠原蛋白底物具有刺激成軟骨的作用[2]。膠原也稱膠原蛋白,是脊椎動(dòng)物體內(nèi)的一種結(jié)構(gòu)蛋白,人體內(nèi)含量非常豐富,占動(dòng)物體膠原纖維固體物的 80%-90% ,占體內(nèi)蛋白質(zhì)總量的25%-30%,也是細(xì)胞外基質(zhì)的主要成分[3]。由于膠原蛋白是天然的生物資源,來(lái)源廣泛且具有獨(dú)特的生物相容性、可降解性、低免疫原性,還有如高拉伸強(qiáng)度、止血性能及促進(jìn)細(xì)胞生長(zhǎng)等獨(dú)特的性能,被越來(lái)越重視。由于膠原蛋白具有止血、促進(jìn)組織再生和功能恢復(fù)的作用,被制成海綿、絲線、薄膜等醫(yī)療器械用于普外科、口腔、血管外科等多個(gè)科室,同時(shí)也因其組織相容性、可降解性被作為皮膚移植材料用于燒傷、創(chuàng)傷的修補(bǔ)。19世紀(jì)80年代,Zyderm膠原植入物被作為一種注射型膠原蛋白制劑在臨床上開(kāi)始使用,在治療面部軟組織變形方面已使用近30年[4]。人們成功將膠原蛋白制成各種各樣的組織工程支架,如皮膚、骨組織、氣管和血管支架,Award等[5]混合自體同源間葉細(xì)胞的莖狀細(xì)胞和膠原蛋白凝膠制作肌腱用于腱后修復(fù)。
Wakitani等[6]用嵌入軟骨細(xì)胞的膠原蛋白凝膠修復(fù)軟骨缺
陷。膠原蛋白作為天然高分子生物材料已被證實(shí)可作為軟骨組織工程支架材料,并且它作為底物能刺激軟骨細(xì)胞生長(zhǎng),可用于體外軟骨細(xì)胞培養(yǎng),但關(guān)于不同類型膠原蛋白刺激成軟骨作用的能力仍存在爭(zhēng)議。本實(shí)驗(yàn)使用Ⅰ、Ⅱ型膠原包被培養(yǎng)板和普通培養(yǎng)板同時(shí)培養(yǎng)人軟骨細(xì)胞,研究
Ⅰ、Ⅱ型膠原蛋白對(duì)人軟骨細(xì)胞生物學(xué)特性的影響。
材料和方法
設(shè)計(jì):前瞻性實(shí)驗(yàn)。
時(shí)間及地點(diǎn):于2008年1月至2009年4月在川北醫(yī)學(xué)院附屬醫(yī)院風(fēng)濕免疫研究所完成。
材料:收集川北醫(yī)學(xué)院附屬醫(yī)院骨科因股骨頸骨折行
全髖置換20例患者的股骨頭標(biāo)本,患者年齡56-84歲,平均66歲。供者對(duì)實(shí)驗(yàn)均知情同意并簽署知情同意書(shū)。
實(shí)驗(yàn)方法:
軟骨細(xì)胞的分離及培養(yǎng):將收集的關(guān)節(jié)軟骨以體積分 數(shù)75%乙醇消毒后,用手術(shù)刀片刮除關(guān)節(jié)表面軟組織及可能覆蓋在其上的滑膜,再將關(guān)節(jié)表面軟骨薄層組織削下來(lái), 使削下的軟骨組織盡量薄,不能削到軟骨下骨。將收集的軟骨組織片放入裝有含青霉素(100 U/mL) 、鏈霉素(100 U/mL)的PBS中漂洗3次,洗去軟骨表面血液及可能存在的滑膜,然后移入小玻璃瓶里,剪成1.0-2.0 mm3,在含雙抗的PBS清洗后轉(zhuǎn)入50 mL離心管內(nèi),加入0.2% Ⅱ型膠原酶2 mL消化。將消化后的軟骨組織和液體通過(guò)200目金屬篩網(wǎng),將未消化的軟骨組織殘?jiān)湃?0 mL離心管中, 加入Ⅱ型膠原酶及DMEM繼續(xù)消化,根據(jù)消化程度決定消化時(shí)間,但消化時(shí)間最長(zhǎng)不超過(guò)12 h為宜。過(guò)濾得到的液體放入15 mL離心管中,1 000 r/min離心7 min,去上清, 加DMEM吹打,盡量輕柔,再次1 000 r/min離心7 min后棄去上清,反復(fù)清洗3次洗去Ⅱ型膠原酶。將錐蟲(chóng)藍(lán)檢測(cè)活力大于95%的原代軟骨細(xì)胞以4×108 L-1濃度接種于25 cm2塑料培養(yǎng)培養(yǎng)瓶。待軟骨細(xì)胞長(zhǎng)滿培養(yǎng)瓶85%以上,棄原培養(yǎng)液,PBS清洗3次,加2.0-3.0 mL含EDTA的0.25%胰酶
(以剛好覆蓋培養(yǎng)瓶底為宜)消化2 min,鏡下觀察貼壁細(xì)胞變圓脫落,待細(xì)胞大部分脫落后,加入含胎牛血清的培養(yǎng)液終止消化。將消化下的細(xì)胞懸液用培養(yǎng)液混勻后移入15 mL離心管,1 000 r/min離心7 min,棄上清,加含體積分?jǐn)?shù)10%胎牛血清的DMEM培養(yǎng)液制成細(xì)胞懸液,計(jì)數(shù)細(xì)胞,按1∶2接種于兩個(gè)25 cm2培養(yǎng)瓶中,繼續(xù)培養(yǎng)箱培養(yǎng), 記錄P0-P7代軟骨細(xì)胞形態(tài)變化,使用選擇培養(yǎng)后細(xì)胞形態(tài)正常、活性強(qiáng)的10組軟骨細(xì)胞進(jìn)行實(shí)驗(yàn),選擇開(kāi)始出現(xiàn)去分化現(xiàn)象的P3代軟骨細(xì)胞進(jìn)行實(shí)驗(yàn)。
Ⅰ、Ⅱ型膠原蛋白培養(yǎng)板的制備:選擇可用于包被培
養(yǎng)培養(yǎng)板的Ⅰ型(C3867,sigma)、Ⅱ型(C9301,sigma) 膠原蛋白,以1%濃度,按8 μg/cm2分別包被培養(yǎng)板記為Ⅰ 型板、Ⅱ型板。
不同培養(yǎng)板對(duì)軟骨細(xì)胞生物學(xué)特性的影響及軟骨細(xì)胞在3種培養(yǎng)板的體外擴(kuò)增增殖速度:將P3代軟骨細(xì)胞以2×107 L-1的細(xì)胞濃度分別接種于普通培養(yǎng)板、Ⅰ型板、Ⅱ 型板,放入孵箱繼續(xù)培養(yǎng)10 d。
使用MTT法繪制細(xì)胞生長(zhǎng)曲線,準(zhǔn)備新的96孔板,在同一96孔板分3區(qū),每一區(qū)32孔,按上述方法鋪上膠原蛋白分別為Ⅰ型板、Ⅱ型板、普遍板。將第3代軟骨細(xì)胞以
1×103接種于3區(qū),每孔加入含胎牛血清、青霉素、鏈霉素
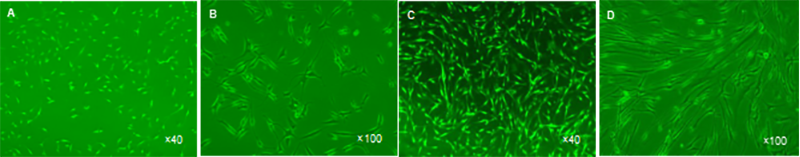
圖 1 人軟骨細(xì)胞的培養(yǎng)(倒置相差顯微鏡)
Figure 1 The culture of human cartilage cells (inverted phase contrast microscope)
圖注:圖中A、B 為第 3 代貼壁軟骨細(xì)胞,以長(zhǎng)橢圓形為主;C、D 為第 7 代貼壁軟骨細(xì)胞,明顯類似于成纖維細(xì)胞。
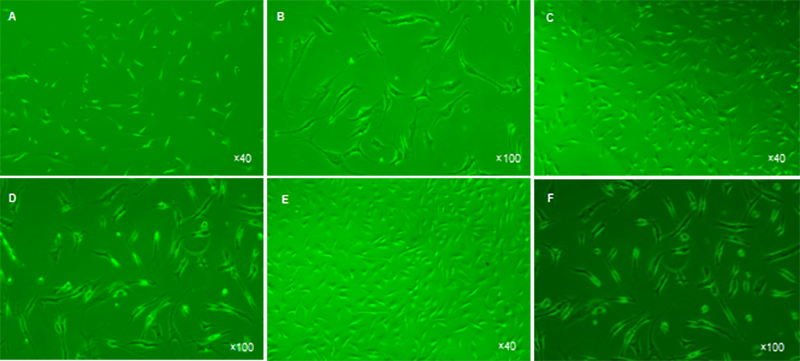
圖 2 將人軟骨細(xì)胞培養(yǎng)于不同培養(yǎng)板 10 d 后的細(xì)胞形態(tài)
Figure 2 Morphology of cartilage cells cultured in different culture plates for 10 days
圖注:圖中A、B 為普通培養(yǎng)板,細(xì)胞數(shù)量少,多為梭形,細(xì)胞出現(xiàn)較多分叉,細(xì)胞核不明顯,無(wú)明顯分裂增殖相;C、D 為Ⅰ型膠原蛋白包被培養(yǎng)板,細(xì)胞外觀立體,表面膠原蛋白覆蓋,細(xì)胞數(shù)多且細(xì)胞短于普通培養(yǎng)板,分叉細(xì)胞較少,具有分裂增殖能力;E、F 為Ⅱ型膠原蛋白包被培養(yǎng)板,細(xì)胞數(shù)量最多,外觀立體,表面膠原蛋白覆蓋,無(wú)明顯分叉細(xì)胞,細(xì)胞核明顯,具有較強(qiáng)的分裂增殖能力。
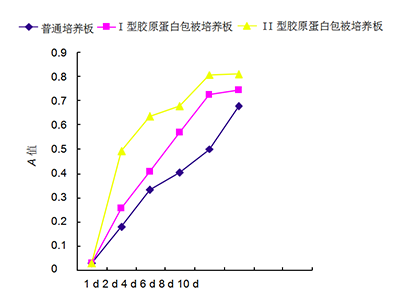 | 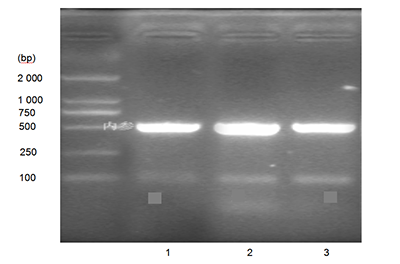 |
圖 3 在不同培養(yǎng)板上培養(yǎng)人軟骨細(xì)胞的生長(zhǎng)曲線 Figure 3 Growth curves of human chondrocytes cultured in various culture plates 圖注:第 2 天即進(jìn)入對(duì)數(shù)生長(zhǎng)期,Ⅰ、Ⅱ型膠原蛋白包被培養(yǎng)板中的軟骨細(xì)胞增殖快于普通培養(yǎng)板,其中Ⅱ型膠原蛋白包被培養(yǎng)板中的軟骨細(xì)胞增殖速度最快。在培養(yǎng)第 8 天時(shí),Ⅰ、Ⅱ型膠原蛋白包被培養(yǎng)板中的軟骨細(xì)胞增殖緩慢,進(jìn)入平臺(tái)期。培養(yǎng)第 10 天時(shí)Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞仍多于另外兩種培養(yǎng)板。 | 圖 4 不同培養(yǎng)板中人軟骨細(xì)胞培養(yǎng)上清液的Ⅱ型膠原基因表達(dá)量Figure 4 Type II collagen gene expression profile in cartilage cell culture supernatant of different plates 圖注:圖中 1 為普通培養(yǎng)板,2 為Ⅱ型膠原蛋白包被培養(yǎng)板,3 為Ⅰ 型膠原蛋白包被培養(yǎng)板。Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞Ⅱ型膠原蛋白基因表達(dá)最高,Ⅰ型膠原蛋白包被培養(yǎng)板其次,最少的為普通培養(yǎng)板。 |
表 1 不同培養(yǎng)板中人軟骨細(xì)胞培養(yǎng)上清液Ⅰ、Ⅱ型膠原蛋白,Ⅱ型膠原基因表達(dá)量及糖胺多糖的水平
Table 1 Type I and type II collagen protein, type II collagen gene
expression, and glycosaminoglycan contents in cartilage cell
| 組別 | Ⅰ型膠原蛋白(mg/L) | Ⅱ型膠原蛋白(mg/L) | Ⅱ型膠原基因表達(dá)量(灰度比值) | 糖胺多糖(mg/L) |
| 普通培養(yǎng)板組 | 308.42±50.85 | 69.88±5.48 | 0.33±0.09 | 1.31±1.23 |
| Ⅰ型膠原蛋白 | 165.03±69.32a | 85.97±10.34a | 0.63±0.08a | 3.37±1.64a |
| 包被培養(yǎng)班組 | ||||
| Ⅱ型膠原蛋白 | 118.09±45.73a | 97.46±9.39ab | 0.80±0.06ab | 4.55±0.87ab |
| 包被培養(yǎng)板組 |
表注:與普通培養(yǎng)板比較,aP < 0.01;與Ⅰ型膠原蛋白包被培養(yǎng)板組比較, bP < 0.01。結(jié)果顯示Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞分泌Ⅱ型膠原蛋白、糖胺多糖最多。
的培養(yǎng)液共200μL。放入37 ℃、體積分?jǐn)?shù)5%CO2、95% 濕度的孵箱繼續(xù)培養(yǎng)10 d,根據(jù)軟骨細(xì)胞生長(zhǎng)速度,檢測(cè)2, 4,6,8,10 d軟骨細(xì)胞吸光度值,每天各個(gè)區(qū)測(cè)4孔。每孔加入配置好的MTT 20 μL,繼續(xù)放入孵箱培養(yǎng)4 h,終止培養(yǎng)后小心吸棄培養(yǎng)液,每孔加入DMSO 150 μL,搖床振蕩10 min使結(jié)晶充分溶解,酶標(biāo)儀選擇570 nm檢測(cè)吸光度值,繪制細(xì)胞生長(zhǎng)曲線。
培養(yǎng)28 d后,采用ELISA法檢測(cè)Ⅰ、Ⅱ型膠原蛋白含量,按ELISA試劑盒說(shuō)明進(jìn)行操作。在450 nm波長(zhǎng)依序測(cè)量各孔的吸光度值(A值)。依據(jù)標(biāo)準(zhǔn)品濃度對(duì)應(yīng)的A值計(jì)算出標(biāo)準(zhǔn)的直線回歸方程,再根據(jù)樣品的A值在回歸方程上計(jì)算出對(duì)應(yīng)的樣品濃度。
培養(yǎng)28 d后,采用反轉(zhuǎn)錄-聚合酶鏈?zhǔn)椒磻?yīng)測(cè)定Ⅱ型膠原蛋白基因表達(dá)。按照Trizol總RNA提取試劑說(shuō)明書(shū)提取軟 骨細(xì)胞總RNA,用凝膠電泳檢測(cè)提取總RNA純度,選擇純度較高的RNA使用反轉(zhuǎn)錄試劑盒進(jìn)行反轉(zhuǎn)錄-聚合酶鏈?zhǔn)椒磻?yīng),根據(jù)GeneBank中Ⅱ型膠原cDNA序列,用Primier
5.0軟件設(shè)計(jì)引物,由北京賽百盛基因有限公司合成。Ⅱ型膠原,上游引物:5-TCC TCT GCG ACG ACA TAA-3,下游引物:5-CAG TGG CGA GGT CAG TT-3。產(chǎn)物大小為108 bp,內(nèi)參基因GAPDH為試劑盒自帶。混勻標(biāo)本,瞬時(shí)離心后放入PCR儀器中,設(shè)置參數(shù)為94 ℃預(yù)變性5 min, 94 ℃變性30 s,50 ℃退火30 s,72 ℃延伸1 min,72 ℃ 再延伸5 min,共35個(gè)循環(huán)。選擇1.5%瓊脂糖凝膠進(jìn)行電泳,根據(jù)凝膠自動(dòng)成像分析儀掃描成像,觀察電泳條帶的灰度值,應(yīng)用相應(yīng)軟件根據(jù)目的基因與內(nèi)參照基因的條帶灰度比值表達(dá)產(chǎn)物進(jìn)行Ⅱ型膠原蛋白半定量分析。
培養(yǎng)28 d后,采用二甲基亞甲基藍(lán)比色法定量檢測(cè)糖胺多糖含量,按照試劑盒說(shuō)明書(shū)操作進(jìn)行。
主要觀察指標(biāo):3種培養(yǎng)板中軟骨細(xì)胞分泌Ⅰ膠原蛋 白、Ⅱ型膠原蛋白及糖胺多糖的量。
統(tǒng)計(jì)學(xué)分析:實(shí)驗(yàn)數(shù)據(jù)采用x±s
表示,采用SPSS 17.0
Hunter[7]認(rèn)為軟骨受到損傷無(wú)法修復(fù),隨著科學(xué)技術(shù)的
分析軟件對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行處理,用單因素方差分析法和q 檢驗(yàn)對(duì)數(shù)據(jù)進(jìn)行檢驗(yàn),P < 0.01為差異有顯著性意義。
結(jié)果 Results
2.1 倒置相差顯微鏡觀察軟骨細(xì)胞形態(tài)
軟骨細(xì)胞培養(yǎng):貼壁的原代軟骨細(xì)胞呈橢圓形、多角 形;傳代軟骨細(xì)胞較原代細(xì)胞稍大,呈橢圓形、多角形或者不規(guī)則形;P3代軟骨細(xì)胞和P1、P2代細(xì)胞相似,但細(xì)
胞逐漸伸展,變成以長(zhǎng)橢圓形為主(圖1A,B);傳至P7代
軟骨細(xì)胞明顯類似于成纖維細(xì)胞(圖1C,D)。
不同培養(yǎng)板培養(yǎng)的軟骨細(xì)胞形態(tài):培養(yǎng)10 d后,普通板中軟骨細(xì)胞數(shù)量少,形態(tài)多為梭形,較細(xì)長(zhǎng)(圖2A);細(xì)胞出現(xiàn)較多分叉,細(xì)胞核不明顯,無(wú)明顯細(xì)胞分裂增殖相(圖2B)。Ⅰ型板細(xì)胞表面被膠原蛋白纖維覆蓋,細(xì)胞外觀立體,細(xì)胞數(shù)多且細(xì)胞短于普通板(圖2C),具有分叉的細(xì)胞較普通板少,分叉的細(xì)胞分支較少,60%細(xì)胞核明顯, 具有分裂增殖能力(圖2D)。Ⅱ型板軟骨細(xì)胞數(shù)明顯較多, 約長(zhǎng)滿培養(yǎng)板90%,且多為短小細(xì)胞,同Ⅰ型板細(xì)胞一樣, 細(xì)胞外觀立體,表面膠原蛋白覆蓋(圖2E),短小細(xì)胞占
2.2不同培養(yǎng)板中軟骨細(xì)胞的增殖速度 觀察細(xì)胞生長(zhǎng)曲線(圖3),第2天即進(jìn)入快速生長(zhǎng)的對(duì)數(shù)生長(zhǎng)期。Ⅰ、Ⅱ 型板中的軟骨細(xì)胞增殖快于普通板,其中Ⅱ型板中的軟骨細(xì)胞增殖速度最快,為Ⅰ型板的2倍、普通板的5倍。在培養(yǎng)第8天時(shí),Ⅰ、Ⅱ型板中的軟骨細(xì)胞增殖緩慢,進(jìn)入平臺(tái)期,考慮細(xì)胞增殖快,接觸抑制。由于Ⅱ型板中軟骨細(xì)胞個(gè)體小于Ⅰ型和普通板,故培養(yǎng)第10天時(shí)Ⅱ型板中軟骨細(xì)胞仍多于另外培養(yǎng)板。
2.3不同培養(yǎng)板對(duì)軟骨細(xì)胞生物學(xué)特性的影響
軟骨細(xì)胞分泌Ⅰ、Ⅱ型膠原蛋白水平及定量檢測(cè):3 種培養(yǎng)板中軟骨細(xì)胞Ⅰ型膠原蛋白分泌量的差異均有顯著性意義(P < 0.01,表1),再使用q檢驗(yàn)進(jìn)行兩兩比較顯示, 普通板中軟骨細(xì)胞分泌Ⅰ型膠原蛋白量高于Ⅰ、Ⅱ型板, 但不能認(rèn)為Ⅰ、Ⅱ型板中軟骨細(xì)胞分泌Ⅰ型膠原蛋白量不同。3種培養(yǎng)板中軟骨細(xì)胞Ⅱ型膠原蛋白分泌量差異有顯著性意義(P < 0.01),使用q檢驗(yàn)進(jìn)行兩兩比較后,顯示Ⅰ、
Ⅱ型板中軟骨細(xì)胞分泌Ⅱ型膠原蛋白量均高于普通板,其中Ⅱ型板中軟骨細(xì)胞分泌Ⅱ型膠原蛋白量最高。根據(jù)半定量PCR檢測(cè)也得出Ⅱ型板中軟骨細(xì)胞Ⅱ型膠原蛋白基因表達(dá)最高,Ⅰ型板其次,最少的為普通板(圖4)。
軟骨細(xì)胞分泌糖胺多糖的量:3種培養(yǎng)板中軟骨細(xì)胞糖
胺多糖分泌量差異有統(tǒng)計(jì)學(xué)意義(P < 0.01),使用q檢驗(yàn)進(jìn)行兩兩比較后顯示,Ⅰ、Ⅱ型板中軟骨細(xì)胞分泌糖胺多糖都高于普通板,其中Ⅱ型培養(yǎng)板中軟骨細(xì)胞分泌量最高(表1)。
討 論 Discussion
Hunter認(rèn)為軟骨受到損傷無(wú)法修復(fù),隨著科學(xué)技術(shù)的發(fā)展和組織工程學(xué)的興起,對(duì)關(guān)節(jié)軟骨缺損的修復(fù)取得了一定進(jìn)展,從促進(jìn)軟骨修復(fù)逐漸發(fā)展到促進(jìn)軟骨重建,如何獲
得足量的健康種子細(xì)胞及支架材料仍是研究的關(guān)鍵所在。獲得足量的種子細(xì)胞主要通過(guò)體外培養(yǎng),軟骨細(xì)胞仍然
是研究的主要細(xì)胞[8],目前軟骨細(xì)胞的體外研究主要集中在兔關(guān)節(jié)軟骨細(xì)胞的培養(yǎng)及誘導(dǎo)成模,動(dòng)物的骨細(xì)胞往往增生活躍,并且由于種屬間差異,只能從一定程度上說(shuō)明研究的意義,本實(shí)驗(yàn)選擇直接從臨床上獲得的人關(guān)節(jié)軟骨細(xì)胞進(jìn)行研究,更符合人實(shí)際生理狀態(tài),更能指導(dǎo)臨床應(yīng)用。關(guān)節(jié)軟骨細(xì)胞成分較單一,通過(guò)消化分離可以獲得高純度的軟骨細(xì)胞[9]。本實(shí)驗(yàn)根據(jù)Tew等[10]報(bào)道使用DMEM配置的0.2%Ⅱ型膠原酶一步法消化軟骨組織獲得軟骨細(xì)胞,避免了多種酶對(duì)軟骨細(xì)胞的毒性,同時(shí)獲得大量具有活力的軟骨細(xì)胞。通過(guò)實(shí)驗(yàn)發(fā)現(xiàn)軟骨細(xì)胞經(jīng)過(guò)3次傳代后逐漸失去其原來(lái)的形態(tài), 出現(xiàn)去分化現(xiàn)象,這與報(bào)道相同[11-13],Watt [14]認(rèn)為,軟骨細(xì)胞梭形變與細(xì)胞表型上的去分化有關(guān),是判斷軟骨細(xì)胞表型是否改變的主要指標(biāo),選擇開(kāi)始有去分化趨勢(shì)的P3代軟骨細(xì)胞進(jìn)行實(shí)驗(yàn),能了解不同培養(yǎng)板對(duì)軟骨細(xì)胞去分化趨勢(shì)的影響。如何利用少量軟骨組織獲得多數(shù)量、高活性、具有分化能力的種子細(xì)胞,是目前關(guān)節(jié)軟骨組織工程制備技術(shù)中的重要問(wèn)題之一[15-16]。
對(duì)去分化軟骨細(xì)胞再次恢復(fù)增殖活性和細(xì)胞表型的能力即再分化進(jìn)行了研究,將已經(jīng)去分化的軟骨細(xì)胞加入三維立體空間培養(yǎng)可以維持甚至恢復(fù)細(xì)胞的特性[17]。如何將單層培養(yǎng)獲得軟骨細(xì)胞與三維立體空間相結(jié)合培養(yǎng)軟骨細(xì)胞,值得深入討論[18]。應(yīng)用于關(guān)節(jié)軟骨修復(fù)重建的材料主要有人工合成材料(PGA、PLA、PLGA等)、天然材料(膠原蛋白、瓊脂糖、海藻酸鈉等)[19-22],其中天然材料膠原蛋白凝膠[23]、膠原蛋白海綿應(yīng)用廣泛[24]。但在臨床研究中發(fā)現(xiàn)軟骨細(xì)胞在Ⅰ型膠原蛋白中仍會(huì)發(fā)生去分化現(xiàn)象,最終形成纖維軟骨,而非透明軟骨;環(huán)境因素對(duì)維持軟骨細(xì)胞的表型至關(guān)重要[25-26],研究發(fā)現(xiàn)軟骨細(xì)胞基質(zhì)中最多的Ⅱ 型膠原蛋白能維持軟骨細(xì)胞的形態(tài),增進(jìn)Ⅱ型膠原蛋白及聚合素的合成[27-28],同時(shí)發(fā)現(xiàn)軟骨細(xì)胞在Ⅱ型膠原蛋白凝膠里分泌糖胺多糖及細(xì)胞因子增加。
本實(shí)驗(yàn)在相同條件下比較了普通板、Ⅰ型膠原蛋白包被板、Ⅱ型膠原蛋白包被培養(yǎng)板對(duì)軟骨細(xì)胞體外培養(yǎng)的影響, 了解Ⅰ、Ⅱ型膠原蛋白哪種更能維持細(xì)胞活性和表型,使細(xì)胞大量擴(kuò)增。通過(guò)細(xì)胞計(jì)數(shù)發(fā)現(xiàn),隨著軟骨細(xì)胞傳代次數(shù)增加,同等面積收獲軟骨細(xì)胞數(shù)逐漸減少,考慮因細(xì)胞增殖活性減低,而且隨著去分化現(xiàn)象的出現(xiàn),細(xì)胞伸展,變?yōu)榧?xì)長(zhǎng), 增加了每個(gè)細(xì)胞所占面積,細(xì)胞的接觸抑制也使單位面積細(xì)胞數(shù)減少。高濃度細(xì)胞培養(yǎng)有益于細(xì)胞表型的維持[30]。膠原蛋白與細(xì)胞有交互作用,能幫助細(xì)胞聚集貼附,故膠原包被培養(yǎng)板貼壁細(xì)胞多,膠原蛋白和軟骨細(xì)胞相結(jié)合形成許多交錯(cuò)網(wǎng)狀結(jié)構(gòu),在鏡下觀察可見(jiàn)軟骨細(xì)胞鑲嵌于膠原蛋白中。觀察細(xì)胞形態(tài)及增殖速度可以看出,Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞較Ⅰ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞形態(tài)小、分叉細(xì)胞少、具有分裂增殖活性的細(xì)胞多,增殖速度明顯快于另兩個(gè)培養(yǎng)板。
細(xì)胞外基質(zhì)是軟骨細(xì)胞生長(zhǎng)和代謝的場(chǎng)所,同時(shí)軟骨細(xì)胞也能合成和分泌細(xì)胞外基質(zhì),是評(píng)價(jià)細(xì)胞生物學(xué)功能活性的主要指標(biāo)[31-32]。Ⅱ型膠原蛋白和蛋白多糖是兩大特異性基質(zhì)成分[33-34],可以通過(guò)檢測(cè)其含量來(lái)判斷軟骨細(xì)胞是否具有分化能力。由于軟骨細(xì)胞發(fā)生去分化現(xiàn)象時(shí)分泌Ⅰ型膠原蛋白而不是Ⅱ型膠原蛋白[35-37],可以通過(guò)測(cè)量軟骨細(xì)胞分泌Ⅰ 型膠原蛋白的量來(lái)了解軟骨細(xì)胞的去分化趨勢(shì)。通過(guò)ELISA 檢測(cè)發(fā)現(xiàn),普通培養(yǎng)板中軟骨細(xì)胞分泌以Ⅰ型膠原蛋白為主,提示經(jīng)過(guò)3次傳代體外培養(yǎng)的軟骨細(xì)胞開(kāi)始出現(xiàn)去分化趨勢(shì)。P3代軟骨細(xì)胞在Ⅰ、Ⅱ型膠原蛋白包被培養(yǎng)板中繼續(xù)培養(yǎng)后分泌Ⅰ型膠原蛋白的量明顯少于普通板,其中Ⅱ型膠原蛋白包被培養(yǎng)板中Ⅰ型膠原蛋白分泌量為普通板的一半,提示兩種膠原蛋白均能延長(zhǎng)軟骨細(xì)胞出現(xiàn)去分化現(xiàn)象的時(shí)間,而該作用在Ⅰ、Ⅱ型膠原蛋白之間比較沒(méi)有明顯差異。
Ⅰ、Ⅱ型膠原蛋白包被培養(yǎng)板中軟骨細(xì)胞分泌Ⅱ型膠原蛋白明顯多于普通板,其中以Ⅱ型膠原蛋白包被板明顯,提示有去分化趨勢(shì)的軟骨細(xì)胞在膠原包被培養(yǎng)板(特別是Ⅱ型膠原 蛋白)中繼續(xù)培養(yǎng)后,軟骨細(xì)胞分化能力強(qiáng)于普通板,說(shuō)明Ⅱ 型膠原蛋白包被培養(yǎng)板能增強(qiáng)軟骨細(xì)胞繼續(xù)分化增殖的能力。本實(shí)驗(yàn)中有去分化趨勢(shì)的軟骨細(xì)胞接種于膠原包被培養(yǎng)板繼續(xù)培養(yǎng)后,雖然軟骨細(xì)胞分泌Ⅱ型膠原蛋白明顯增加, 但仍是以分泌Ⅰ型膠原蛋白為主,提示細(xì)胞的再分化只有經(jīng)過(guò)長(zhǎng)時(shí)間培養(yǎng)才會(huì)完成,與Binette等[38-39]研究相同。
本實(shí)驗(yàn)發(fā)現(xiàn)膠原蛋白和軟骨細(xì)胞有交互作用,膠原蛋白包被的培養(yǎng)板應(yīng)用于原代軟骨細(xì)胞體外培養(yǎng)時(shí)能使細(xì)胞盡早貼壁,減少懸浮死細(xì)胞量。膠原蛋白包被培養(yǎng)板培養(yǎng)軟骨細(xì)胞優(yōu)于普通培養(yǎng)板,其中Ⅱ型膠原蛋白包被培養(yǎng)板在培養(yǎng)軟骨細(xì)胞時(shí)更能維持細(xì)胞形態(tài),延長(zhǎng)去分化現(xiàn)象出現(xiàn)的時(shí)間,更利于細(xì)胞再分化。實(shí)驗(yàn)為后期進(jìn)行軟骨細(xì)胞在Ⅱ型膠原蛋白凝膠里進(jìn)行三維立體培養(yǎng),甚至軟骨細(xì)胞-Ⅱ型膠原蛋白凝膠復(fù)合物臨床實(shí)驗(yàn)奠定了基礎(chǔ)。
致謝:感謝川北醫(yī)學(xué)院附屬醫(yī)院風(fēng)濕免疫研究所提供實(shí)驗(yàn)室及實(shí)驗(yàn)室老師提供的實(shí)驗(yàn)技術(shù)支持。
作者貢獻(xiàn):蔚芃進(jìn)行實(shí)驗(yàn)設(shè)計(jì)、審校稿件,蔣萍完成了資料收集、實(shí)驗(yàn)實(shí)施及最終成文,對(duì)文章負(fù)責(zé),趙明才完成了實(shí)驗(yàn)評(píng)估及實(shí)驗(yàn)技術(shù)指導(dǎo),陳瓊、王梓幫助完成了實(shí)驗(yàn)數(shù)據(jù)統(tǒng)計(jì)、分析。
利益沖突:文章及內(nèi)容不涉及相關(guān)利益沖突。
倫理要求:采用川北醫(yī)學(xué)院附屬醫(yī)院骨科行人工股骨頭置換 后丟棄的股骨頭標(biāo)本進(jìn)行實(shí)驗(yàn),患者均知情,川北醫(yī)學(xué)院附屬醫(yī)院為三級(jí)甲等醫(yī)院,具有完成該手術(shù)及進(jìn)行實(shí)驗(yàn)的條件、資質(zhì)。學(xué)術(shù)術(shù)語(yǔ):膠原蛋白-是脊柱動(dòng)物含量最多、分布最廣的蛋白
質(zhì),在體內(nèi)具有廣泛的生物學(xué)活性;體外應(yīng)用具有低免疫原性、良好的生物相容性、可降解性、可參與組織修復(fù)重建等優(yōu)越性, 是最重要的天然可降解的生物醫(yī)用材料。
作者聲明:文章為原創(chuàng)作品,無(wú)抄襲剽竊,無(wú)泄密及署名和
專利爭(zhēng)議,內(nèi)容及數(shù)據(jù)真實(shí),文責(zé)自負(fù)。
參考文獻(xiàn)
[1]Brittberg M,Lindahl A,Nilsson A,et al.Treatment of deep cartilage defects in the Knee with autologous chondrocytes transplantation.N Engl J Med. 1994;331(14):889-895.
[2]Kosher RA, Church RL. Stimulation of in vitro somite chondrogenesis by procollagen and collagen. Nature. 1975;258(5533):327-330.
[3]Shouldes MD,Raines RT.Collagen structure and stability.Annu Rev Biochem.2009;78:929-958.
[4]顧其勝.膠原蛋白的臨床應(yīng)用[J].中國(guó)修復(fù)重建外科雜志, 2006, 20(10):1052-1057.
[5]Award H, Butler DL,Boivin GP,et al.Autologous mesenchymal stem cell-mediated repair of tendon.Tissue Eng. 1999;5(3): 267-277.
[6]Wakitani S,Goto T,Young RG,et al.Repair of large fullthickness ar-ticular cartilage defects with all graft articular chondrocytes embedded in a collagen gel.Tissue Eng.1998;4(4):429-444.
[7]Hunter W.Of the structure and diseases of articulating cartilages. Clin orthop Relat Res.1995;(317):3-6.
[8]Schulz RM,Bader A.Cartilage tissue engineering and bioreactor systems for the cultivation and stimulaion of chondrocytes.Eur Biophys J.2007;36(4-5):539-568.
[9]Buckwalter JA,Mankin HJ.Articular cartilage: tissue design and chondrocyte matrix interactions.AAOS Inst Course Lect. 1998;47(3):477-486.
[10]Tew SR,Murdoch AD,Rauchenberg RP,et al.Cellular methods in cartilage research: primary human chondrocytes in culture and chondrogenesis in human bone marrow stem cells. Methods.2008;45(1):2-9.
[11]Outerbridge HK,Outerbridge RE,Smith DE.Osteochondral defects in the knee, A treatment using lateral patella autografts.Clin Orthop Relat Res.2000;37(7):145-151.
[12]Shapiro F,Koide S,Glimcher MJ.Cell origin and differentiation in the repair of full-thickness detects of articular cartilage.J Bone Joint Surg Am .1993;75(4):532-553.
[13]Schulze-Tanzil G,de Souza P,Villegas Castrejon H,et al.Redifferentiation of dedifferentiated human chondrocytes in high-density cultures.Cell Tissue Res. 2002;308(3):371-379.
[14]Watt F. Effect of seeding density on stability of the dedifferentiated phenotype of pig articular chondrocytes in culture.J Cell Sci.1988;89:373-378.
[15]Temenoff JS,Mikos AG.Review: tissue engineering for regeneration of articular cartilage. Biomaterials. 2000;21(3):431-440.
[16]Nerem RM,Sambanis A.Tissue engineering : from biology to biological substitutes.Tissue Eng.1995;1(1):3-13.
[17]Benya PD,Shaffer JD.Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels.Cell. 1982;30(1):215-224.
[18]Kuriwaka M,Ochi M,Uchio Y,et al.Optimum combination of monolayer and three-dimensional cultures for cartilage-like tissue engineering.Tissue Eng.2003;9(1):41-49.
[19]Pieper JS,Vander Kraan PM,Hafmans T,et al.Crosslinked type II collagen matrices:preparation,characterization,and potential for cartilage ngineering.Biomaterials.2002;23(15):3183-3192.
[20]Van Beuningen HM,Stoop R,Buma P,et al.Phenotypic differences in murine chondrocyte cell lines derived from mature articular cartilage.Osteoarthritis Cartiage. 2002; 10(12): 977-986.
[21]Ushida T,Furukawa K,Toita K,et al.Three-dimensional seeding of chondrocytes encapsulated in collagen gel into PLLA scaffolds.Cell Transplant.2002;11:489-494.
[22]Ma,HL,Hung,SC,Lin SY,Chen YL,et al.Chonderogenesis of human mesenchymal stem cells encapsulated in alginate beads.J Biomed Mater Res.2003;64(2):273-281.
[23]Kimura T,Yasui N,Ohsawa S,et al.Chondrocytes embedded in collagen gels maintain cartilage phenotype dur ing long term cultures.Clin Orthop Relat Res. 1984;(186):231-239.
[24]Speer DP,Chvapil M,Volz R,et al.Enhancement of healing in osteochondral defects by collagen sponge implants.Clin Orthop Relat Res.1979;(144):326-335.
[25]Ito Y,Ochi M,Adachi N,et al.Repair of osteochondral defect with tissue-engineered chondral plug in a rabbit model. Arthroscopy.2005;21(10):1155-1163.
[26]Darting EM,Athanasiou KA.Retaining zonal chondrocyte phenotype by means of novel growth environments.Tissue Eng.2005;11(3-4):395-403.
[27]Qi WN,Scully SP.Extracelluar collagen regulates expression of transforming growth factorth factor-betal gene.J Orthop Res.2000;18:928-932.
[28]Qi WN,Scully SP.Effect of type II collagen in chondrocyte response to TGF-beta1 regulation.Exp Cell Res. 1998;241(1): 142-150.
[29]Qui W,Scully S.Extracellular collagens demonstrate a type specific influence on cytokine regulation of articular chondrocytes.Proc of the ORS, Atlanta, GA; 1996:308.
[30]Tew SR,Murdoch AD,Rauchenberg RP,et al.Cellular methods in cartilage research: primary human chondrocytes in culture and chondrogenesis in human bone marrow stem cells. Methods.2008;45(1):2-9.
[31]周強(qiáng),李起鴻,戴剛.骺板軟骨細(xì)胞復(fù)合三維支架體外構(gòu)建組織工程軟骨的研究[J].中國(guó)修復(fù)重建外科雜志,2004,18(2):92-95.
[32]林建華,陳曉東,鄧凌霄,等.大鼠軟骨細(xì)胞復(fù)制性老化的體外觀察
[J].中國(guó)修復(fù)重建外科雜志,2007,21(11):1228-1232.
[33]周強(qiáng),李起鴻,戴剛.三步酶消化法高效分離兔原代關(guān)節(jié)軟骨細(xì)胞及體外培養(yǎng)觀察[J].中華外科雜志,2005,43(8):522-526.
[34]Sandell LJ,Sugai JV,Trippel SB.Expression of collagens Ⅰ, Ⅱ, Ⅹ,and Ⅺ and aggrecan mRNAs by bovine growth plate chondrocytes insitu.J Orthop Res.1994;12(1):1-14.
[35]Miot S,Woodfield T,Daniels AU,et al. Effects of scaffold composition and architecture on human nasal chondrocyte redifferentiation and cartilaginous matrix deposition. Biomaterials.2005;26(15):2479-2489.
[36]張艷,柴崗,劉偉,等.體外培養(yǎng)過(guò)程中去分化的人軟骨細(xì)胞基因表達(dá)譜的變化[J].中華整形外科雜志,2007,23(4):331-334.
[37]Karlsen TA,Shahdadfar A,Brinchmann JE.Human primary articular chondrocytes, chondroblasts-like cells, and dedifferentiated chondrocytes: differences in gene, microRNA,and protein expression and phenotype.Tissue Eng Part C Methods. 2011;17(2):219-227.
[38]Binette F,McQuaid DP,Haudenschild,DR,et al.Expression of a stable articular cartilage phenotype without evidence of hypertrophy by adult human articular chondrocytes in vitro.J Orthop Res.1998;16:207-216.
[39]Liu H, Lee YW, Dean,MF. Re-expression of differentiated proteoglycan phenotype by dedifferentiated human chondrocytes during culture in alginate beads.Biochim Biophys Acta.1998;1425:505-515.
“以上內(nèi)容為營(yíng)養(yǎng)科普知識(shí),僅供消費(fèi)者參考學(xué)習(xí)。相關(guān)內(nèi)容不代表產(chǎn)品功效,請(qǐng)消費(fèi)者理性閱讀。”
